


A fines del año 2021 se aprobó ONCOVET CL de Laboratorio Chemovet (Argentina) convirtiéndose en el primer medicamento a nivel mundial con clorambucilo para exclusivo uso veterinario.
Este importante medicamento de la línea ONCOVET fortalece una nueva herramienta terapéutica en medicina veterinaria en pacientes con cáncer y enfermedades inmunomediadas.
Es un medicamento diseñado con los más altos estándares de tecnología farmacéutica oncológica para medicina veterinaria.
ONCOVET CL se utiliza principalmente en caninos para el tratamiento de pacientes oncológicos que padecen linfomas, leucemia linfócitica crónica, timoma, neoplasias de glándulas salivares, mastocitomas, mieloma múltiple, adenocarcinoma ovárico, carcinoma de células tradicionales de vejiga, y para enfermedades inmunomediadas tales como enteropatía crónica inmunomediada, enfermedad intestinal inflamatoria, policitemia vera y macroglobulinemia, glomerulonefritis autoinmune, pénfigo foliáceo y miastenia gravis y en felinos con enfermedades oncológicas en linfoma, leucemia y afeccciones inmunomediadas tales como pénfigo foliáceo, complejo pénfigo, enfermedad de Bowel, peritonitis infecciosa, anemia inmunomediada y prurito idiopático.

En esta oportunidad desarrollamos resumidamente 2 de sus amplias indicaciones:
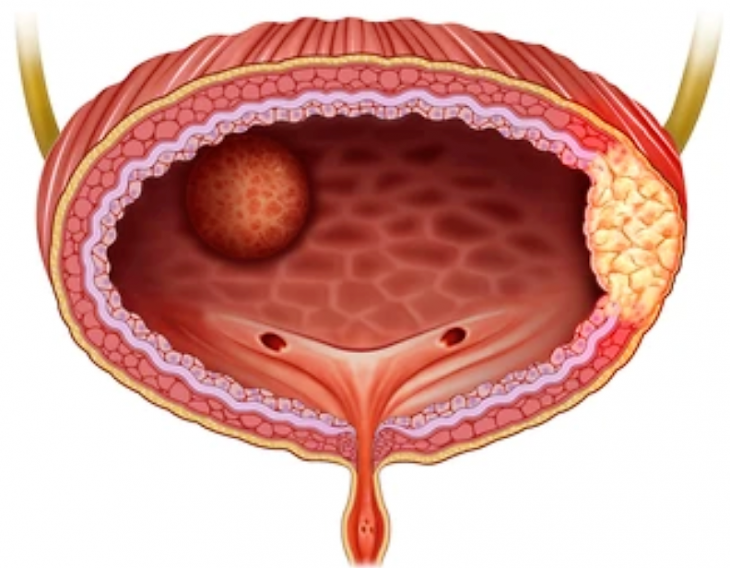
- Carcinoma de células de transicionales en el tracto urinario en caninos
- Linfoma intestinal en felinos
Carcinoma de células de transicionales en el tracto urinario en caninos
El cáncer más común del tracto urinario canino es el carcinoma de células de transición (CCT), también conocido como carcinoma urotelial (CU). Se estima que representa del 1% al 2% de todos los cánceres caninos, con una prevalencia creciente observada en práctica diaria.
Los factores de riesgo para CCT/CU incluyen factores genéticos, la obesidad, el sexo femenino y la exposición a agentes ambientales específicos, como el contacto de plantas tratadas con herbicidas. Se ha observado una incidencia elevada en varias razas de perros, incluido el terrier escocés, collie, terriers blancos de West Highland, fox terriers y beagles.
A pesar de la conciencia de los profesionales veterinarios, los tumores CCT/CU a menudo están localmente avanzados en el momento del diagnóstico.
La ubicación de la enfermedad limita con frecuencia las opciones quirúrgicas definitivas. Como tal, la mayoría de los perros diagnosticados con CCT/CU sucumben a complicaciones anatómicas y metabólicas asociadas con la progresión del tumor local (por ejemplo, obstrucción urinaria, dolor, azotemia).
El CCT/CU a menudo se identifica después de la observación de signos del tracto urinario inferior (por ej.: estranguria, polaquiuria, hematuria). Estos signos también pueden ser el resultado de otros problemas de salud de la vejiga más comunes, como UTI, pólipos, prostatitis y cálculos en la vejiga.
Debido a que las infecciones de la vejiga son una razón común por la que los perros presentan signos del tracto urinario inferior, el tratamiento de primera línea a menudo implica antibióticos y/o medicamentos antiinflamatorios, y la recurrencia de los signos finalmente genera preocupación por el CCT/CU.
La histopatología es el estándar de oro para la detección de CCT/CU, pero este enfoque requiere procedimientos invasivos.
El uso de opciones tradicionales no invasivas se basa en la identificación citológica de células epiteliales anormales en muestras de orina, lo que puede ser engañoso y contribuir a una detección tardía.
Una vez que se diagnostica CCT/CU, las opciones de tratamiento varían y pueden incluir inhibidores de la ciclooxigenasa, quimioterapia citotóxica, radioterapia y/o cirugía. El pronóstico generalmente es reservado.
Los estudios moleculares de CCT/CU canino han identificado la presencia de una mutación de base única en el gen BRAF canino, que se ha detectado en ≈85% de los casos estudiados.
La prevalencia notablemente alta de esta mutación en pacientes con CCT/CU en comparación con pacientes con otros cánceres ha facilitado el desarrollo de una prueba molecular comercialmente disponible con alta sensibilidad y especificidad utilizando una muestra de orina no invasiva (captura libre). Además, utilizando un enfoque técnico que no se ve afectado por la presencia de sangre, proteína y las bacterias en la orina aumenta la utilidad de este enfoque para ayudar a la detección de CCT/CU en perros con signos clínicos evidentes.
La detección temprana puede aumentar el tiempo para la intervención adecuada, lo que aumenta las oportunidades para mejorar potencialmente los resultados. Además, la detección de mutaciones de bajo nivel, asociadas con casos preclínicos de CCT/CU, brinda oportunidades para que los veterinarios consideren el manejo más adecuado, lo que podría mejorar la calidad y la duración de vida de estos pacientes afectados.
Es fundamental centrarse en medidas que optimicen la salud del tracto urinario canino, como evitar los factores de riesgo ambientales, mantener un peso saludable y garantizar una dieta saludable, incluida la suplementación con vegetales crucíferos.
Estudios con suplementos dietéticos destinados a respaldar el tratamiento de los cánceres humanos, incluido el de vejiga, sugieren que el sulforafano, que se encuentra en las verduras crucíferas, puede brindar beneficios adicionales a los humanos, con una posible traducción a los pacientes caninos.
Tratamiento Quimioterápico
Dentro de los tratamientos quimioterápicos, ONCOVET CL (clorambucilo) es el único medicamento específico de uso veterinario aprobado para esta afección en la República Argentina.
Se utiliza generalmente en regímenes de quimioterapia metronómica (en dosis bajas).
Se realizó un ensayo clínico de clorambucilo oral metronómico (4 mg/m2 diarios) en 31 perros con CCT/CU, de los cuales habían fracasado con otras quimioterapias previas. Las respuestas incluyeron remisión parcial en un perro (3 %) y enfermedad estable en 20 perros (67 %). La mediana de un intervalo libre de progresión y el tiempo medio de sobreviva desde el inicio del clorambucilo fue de 119 días y 221 días, respectivamente.
La calidad de vida era excelente. Aunque la toxicidad fue mínima en este estudio. La dosis de clorambucilo utilizada en el ensayo de CCT/CU fue de 4 mg/m2 diarios, porque era la dosificación más bajas y más eficaz.
Hay tres dosis diferentes de clorambucilo que pueden ser utilizadas: 4 mg/m2, 6 mg/m2 y 8 mg/m2. Las dosis superiores a 4 mg/m2 se asociaron con más toxicidad gastrointestinal y de la médula ósea, pero no mejoraron los efectos antitumorales. De 34 perros que recibieron 4 y 8 mg/m2, se observó supresión de la médula ósea en el 10 % de los perros a los 90 días y en el 80 % de los perros al año. La mayor parte de la toxicidad fue de grado 1 o 2, pero esto justifica la necesidad de un control cuidadoso.
TIPS para poner en práctica:
1) Los signos clínicos asociados con la progresión del tumor local son los factores limitantes más comunes para los perros diagnosticados con CCT/CU.
2) Aunque la tomografía computada y la ultrasonografía son útiles para monitorear los cambios en el tamaño del tumor local, estas modalidades de imágenes por sí solas no deberían impulsar la toma de decisiones clínicas. Todas las fuentes de información clínica, diagnóstica y radiológica deben combinarse como guía en el manejo clínico de perros con CCT/CU.
3) ONCOVET CL es el quimioterápico autorizado por organismos regulatorio en medicina veterinaria, más seguro y de elección para pacientes con CCT/CU.
4) Las terapias combinadas y herramientas de evaluación de la respuesta son relevantes para mejorar el manejo del CCT/CU canino.
¿Cómo se trata a los gatos con linfoma intestinal?
El tratamiento del linfoma intestinal felino requiere instituir quimioterapia sistémica, con o sin resección quirúrgica de las lesiones intestinales focales.
Alrededor del 40 % de los gatos con linfoma tendrán una enfermedad primaria en su tracto intestinal.
En general, el linfoma intestinal se origina en las células B y surge en gatos geriátricos que tienen resultados negativos en las pruebas para el virus de la leucemia felina.
Anatómicamente, la mayoría de los linfomas intestinales afectan al intestino delgado, con menor frecuencia al estómago, intestino grueso y colon.
El linfoma intestinal puede manifestarse como enfermedad infiltrante difusa o lesiones focales solitarias, a menudo acompañadas de afectación de los ganglios linfáticos mesentéricos.
El tratamiento del linfoma intestinal felino requiere instituir quimioterapia sistémica, con o sin resección quirúrgica de las lesiones intestinales focales.
La elección de los protocolos de quimioterapia sistémica depende del grado histológico (bajo, intermedio o alto).
El linfoma intestinal de bajo grado se puede controlar con terapias orales a largo plazo tales como ONCOVET CL (clorambucilo) a razón de 4 mg/m2 por vía oral en días alternos y prednisolona a razón de 1 mg/kg por vía oral al día.
El pronóstico para gatos con linfoma intestinal de bajo grado puede ser relativamente bueno; muchos gatos viven años después del diagnóstico y tratamiento con ONCOVET CL.

Ha sido publicado un estudio retrospectivo para evaluar la respuesta al tratamiento, la duración de la remisión y la supervivencia en gatos con linfoma de bajo grado. Se incluyeron 41 gatos en el estudio.
La respuesta al tratamiento fue evaluada por el médico examinador y se clasificó como remisión completa (100 % de resolución de los signos clínicos durante > 30 días) o parciales (> 50 % pero < 100 % de resolución de los signos clínicos durante > 30 días).
Los gatos que informaron tener una mejoría < 50 % o respuestas de < 30 días se consideraron no respondedores. La información sobre la respuesta no estaba disponible para 2 gatos con linfoma del tracto gastrointestinal, pero 37 de los 39 gatos restantes (95 %) respondieron a la quimioterapia. A juzgar por los registros médicos, el 56% (22) logró una respuesta completa y el 39% (15) logró una respuesta parcial.
De los 37 que respondieron, 13 recayeron o la enfermedad progresó durante el período de seguimiento. La mediana de la duración de la respuesta de los 15 gatos con una respuesta parcial fue de 14 meses y la mediana de la duración de la respuesta de los 22 gatos con una respuesta completa fue de 29 meses.
El 92 % de los gatos respondieron al tratamiento durante una mediana de > 2,5 años. En base a los resultados, el pronóstico para gatos con linfoma linfocítico de bajo grado tratados con prednisona y clorambucilo es favorable.
Este estudio muestra que los gatos con linfoma de bajo grado en cualquier sitio (no solo en el tracto gastrointestinal como se informó anteriormente) tienen un pronóstico excelente con quimioterapia de impacto relativamente bajo (prednisolona oral y clorambucilo).
En cuanto al linfoma de alto grado, la respuesta completa a la terapia se asocia con una remisión más prolongada (29 meses en este estudio), pero incluso los gatos que tenían una respuesta > 50 % mantuvieron esa respuesta durante un promedio de más de 1 año.
Se puede alentar a los médicos generales a usar dicho tratamiento, ya que se percibe como de "bajo riesgo", pero la supresión acumulativa de la médula ósea, en particular durante ciclos de tratamiento prolongados, así como la toxicidad hepática menos común, requieren que los pacientes sean monitoreados cuidadosamente durante la terapia.
También se debe enfatizar que estos resultados se aplican solo al linfoma de bajo grado determinado por biopsia; el diagnóstico citológico de esta enfermedad no es suficiente.





