


Por: Martín Soberano

Introducción
Los mastocitos son las células hematopoyéticas que realizan sus funciones relacionadas con el sistema inmunitario en muchos tejidos, pero especialmente en la dermis, tracto gastrointestinal y los pulmones. Los trastornos proliferativos de los mastocitos incluyen el mastocitoma, más común en perros y gatos, pero también la mastocitosis sistémica, más común en los seres humanos, en la infancia y asociada a la leucemia mieloide de mastocitos.
El término mastocitosis es utilizado para describir procesos de causa desconocida, caracterizada por la proliferación sistémica de mastocitos neoplásicos o no neoplásicos, con un aumento de estas células en el torrente sanguíneo (mastocitemia), médula ósea, los ganglios linfáticos, bazo e hígado. La leucemia mieloide de mastocitos, más a menudo diagnosticada en gatos que en perros, es una enfermedad rara en medicina veterinaria, posiblemente asociada con mastocitosis sistémica. A pesar de la ausencia de criterios de clasificación, el diagnóstico se basa en la identificación de mastocitos con una concentración igual o superior al 10 % de los leucocitos en sangre periférica de animales con mastocitosis sistémica, o cuando son identificado más de un 1 % de células mastocitos en las células nucleadas de la médula. En medicina, sin embargo, el paciente debe necesariamente presentar mastocitos atípicos circulantes, con características citoquímicas de mastocitos y difusa infiltración de mastocitos atípicos en la médula ósea. La mastocitemia también puede ocurrir, aunque raramente, en anemia regenerativa, trastornos inflamatorios (sobre todo por la enteritis por parvovirus, pericarditis, pleuritis, peritonitis, neumonía por aspiración, necrosis pancreática aguda) o alérgicas (hipersensibilidad a la picadura de pulgas, hipersensibilidad alimentaria y atopia) y neoplasias no mastocíticas. La proliferación no neoplásica de mastocitos o simplemente una hiperplasia similar a la urticaria pigmentosa en seres humanos, puede ocurrir en perros de distintas edades, cursando entonces con prurito, pero con una cura espontánea o remisión a largo plazo después del uso de glucocorticoides.
Incidencia
El mastocitoma o tumor de mastocitos (mast cell tumor) es la proliferación neoplásica de mastocitos y puede ocurrir en la forma cutánea (en la dermis o tejido subcutáneo) o en la forma extracutánea (con reportes en el tracto gastrointestinal, uréter, médula espinal, laringe y tráquea), pero esta forma es rara en perros.
El mastocitoma ocurre principalmente en perros de edad avanzada entre 7-9 años, aunque puede desarrollarse en animales más jóvenes.
La predilección por el género no está bien establecida. Sin embargo, un estudio comparó la incidencia de mastocitoma entre machos y hembras, castrados y no castrados, en una población heterogénea con perros sin raza definida y varias razas puras. Cuando se realiza la comparación entre perros no castrados, observaron mayor incidencia en machos (p=0,04). Las hembras castradas presentaron mayor predisposición a desarrollar cáncer que las hembras no castradas (p< 0,01). En los machos, aunque no fue estadísticamente significativo, se observó mayor incidencia en machos castrados comparado con los no castrados (p=0,14).
A pesar de la mayor incidencia en perros sin raza definida, probablemente relacionado con el perfil de la población, existe mayor riesgo en las razas que tienen el Bulldog como antepasado común (Bulldog Inglés, Bulldog Francés, Boxer o Pug), pero también el perro de la Montaña Bernese, Gran Danés, Weimaraner, Golden Retriever, Labrador Retriever, American Staffordshire Terrier y Shar-pei. Otras razas presentan menor incidencia de mastocitoma cutáneo como Pastor Alemán, Cocker Spaniel y razas pequeñas como el Yorkshire Terrier, Caniche miniatura, Dachshund, Shih-tzu, Maltés y Chihuahua.
Las razas pequeñas comparten un haplotipo común del factor de crecimiento semejante a insulina-1 (FCSI-1), producida por el hígado, que tiene una gran influencia en la definición del tamaño del cuerpo del animal. Este haplotipo está ausente en casi todas las grandes razas de perros, lo que puede estar relacionado con una mayor incidencia del mastocitoma canino, así como tener una influencia también en la supervivencia y proliferación celular mediante la interferencia en el funcionamiento de numerosas proteínas-cinasas.
Etiología
Los cambios genéticos implicados en la carcinogénesis del mastocitoma canino no se entienden todavía completamente. A pesar de la importancia de los cambios en la función del gen supresor de tumores p53 en la especie humana, en un estudio con 71 perros con mastocitoma cutáneo, solo 17 demostró reducida la expresión de p53. Se han identificado mutaciones en un pequeño número de pacientes con mastocitoma, pero los cambios en la función de la proteína p53 pueden estar relacionados con otros mecanismos, como la sobreexpresión del protooncogén MDM-2. Este cambio resultó ser común en el mastocitoma, en un estudio inmunohistoquímico, en el 55 % de los perros y estaba correlacionado directamente con un mayor grado histológico del mastocitoma ya que era más frecuente en los mastocitomas grado III que en los de grado II (p <0,05). El producto final de ese protooncogén está relacionado con el transporte de la p53 en el citoplasma, que favorece su degradación. La pérdida de la función normal de la p53 puede conducir a la reducción de la expresión de los inhibidores de la ciclina dependiente de kinasa CDKN1A (p21) y CDKN1B (p27), que en condiciones fisiológicas actúan como reguladores de la proliferación celular. Un estudio concluyó que la pérdida o ausencia de p27 puede estar relacionada con la iniciación tumoral de mastocitoma, y la expresión de p21 se correlaciona positivamente, posiblemente con la progresión del tumor.
Comportamiento natural
Los mastocitos son las células del sistema hematopoyético, derivado de células pluripotenciales CD34 + progenitoras en la médula ósea. Después de llegar a la circulación sanguínea, migran rápidamente al tejido conjuntivo, donde maduran y cumplen funciones relacionadas con el sistema inmunitario. La identificación de mastocitos en el torrente sanguíneo es rara y se considera anormal. Sin embargo, están presentes en distintos órganos y tejidos en distintas especies animales, con mayor concentración en la piel, pulmones y tracto gastrointestinal, órganos que tienen contacto primario con antígenos externos. Una pequeña porción de los mastocitos puede encontrarse también en los ganglios linfáticos, en la región paracortical (linfocitos T).
Los mediadores inflamatorios almacenados en los gránulos de los mastocitos incluyen:
- Histamina
- Heparina
- Enzimas proteolíticas
- Factores de crecimiento
- Factores quimiotácticos
- Citocinas (factor de necrosis tumoral-alfa o interleucina-6, por ejemplo)
- Metabolitos del ácido araquidónico
Signos clínicos
La gran mayoría de los mastocitomas se presenta como formaciones solitarias dermoepidérmicas superficiales que se mueven junto con la piel o como formaciones subcutáneas en las que se pueden mover la piel sobrepuesta libremente sobre el tumor. Aunque siempre existe la posibilidad de que se produzca un mastocitoma canino extra cutáneo primario, esta forma visceral generalmente es consecuencia de la presencia de un foco metastásico de lesión cutánea indiferenciada primaria, acompañada de una linfadenopatía y hepatoesplenomegalia.

En estos casos se puede encontrar efusiones en cavidades con una alta concentración de mastocitos neoplásicos.
La forma subcutánea puede confundirse fácilmente con los lipomas comunes, debido a su ubicación y consistencia blanda. A pesar del crecimiento generalmente lento, hasta el 30 % pueden tener ulceración. Hasta el 10-15 % de los pacientes puede desarrollar un marco multicéntrico, caracterizado por tres o más lesiones de aspecto concomitante o secuencial. Es prácticamente imposible determinar si el marco multicéntrico representa una forma anormal de metástasis o son tumores independientes.

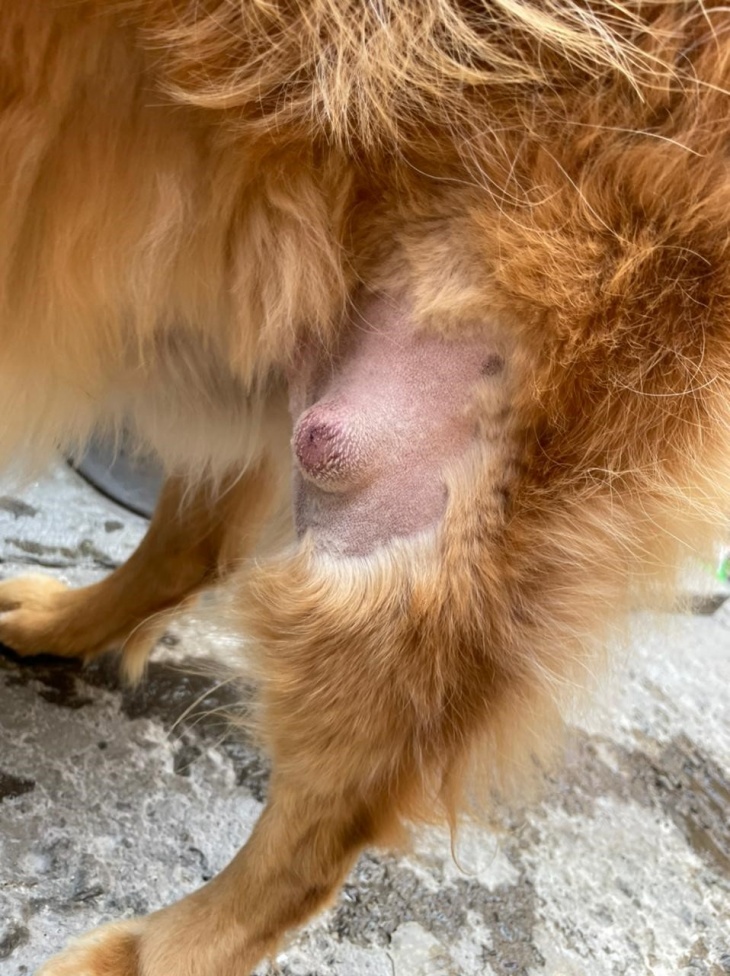
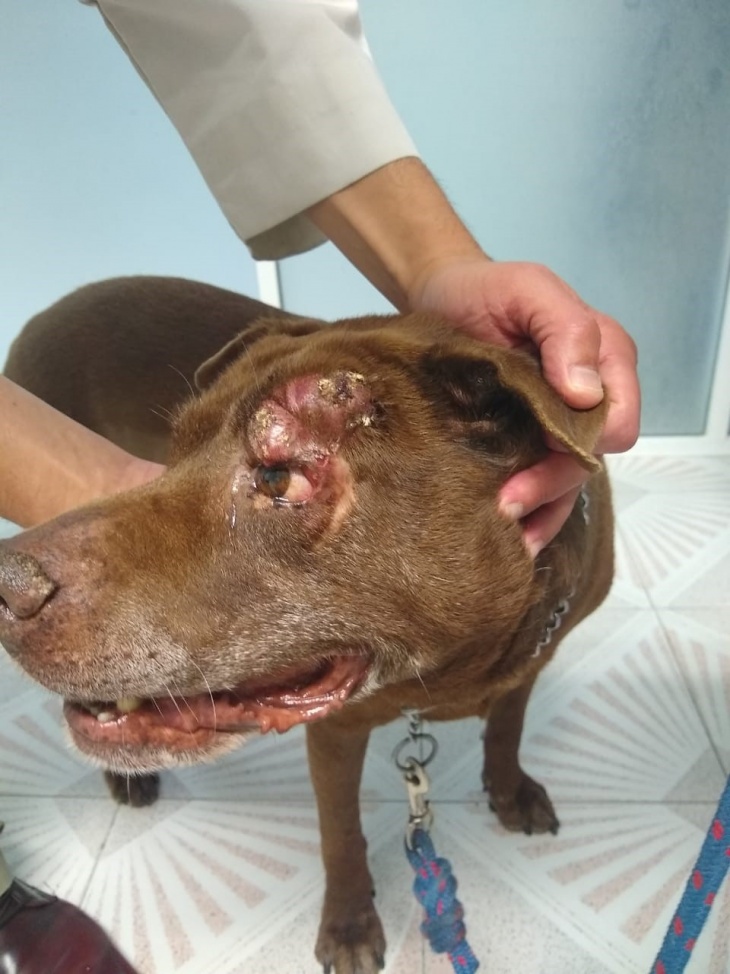
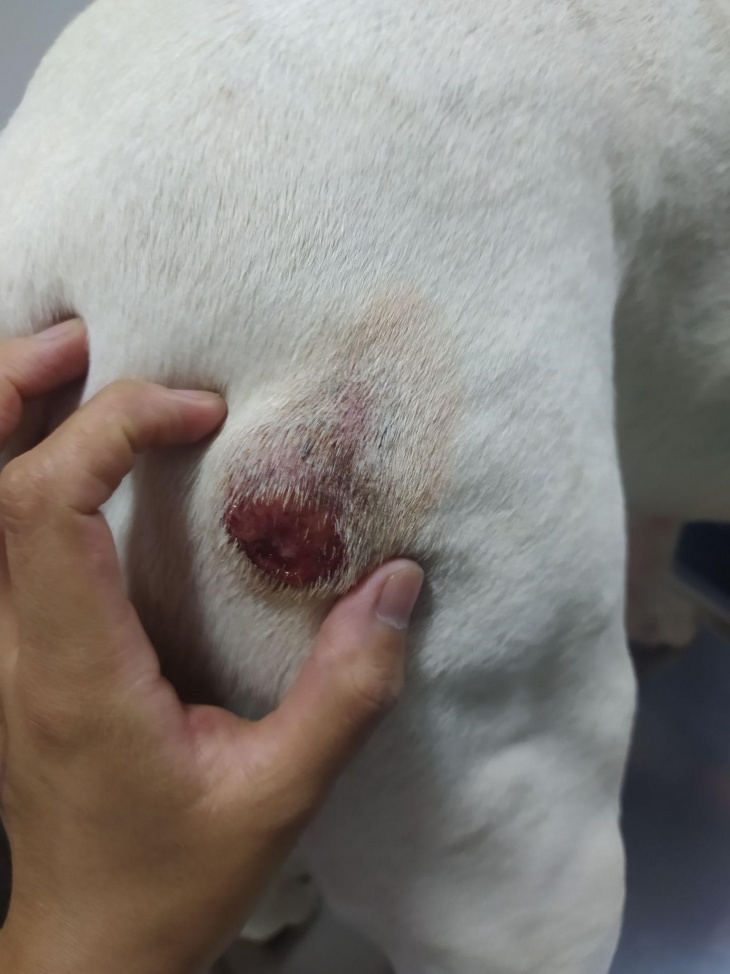
Tumores con una historia de aumento y disminución de tamaño, espontáneamente, son sugestivos de mastocitoma. Los mastocitomas de bajo grado histológico bien diferenciado se presentan generalmente de forma solitaria, no ulcerada, con una consistencia de suave a firme, con un tamaño de 1 a 4 cm de diámetro, sin historia de crecimiento o con evolución lenta. Por el contrario, se tiende a clasificar como de alto grado poco diferenciado los tumores con diferentes tamaños, de rápido crecimiento, a veces con ulceraciones y con un aspecto macroscópico inflamado (lesiones calientes, a veces eritematosas e inflamadas).
El signo de Darier (edema y eritema alrededor del tumor) puede verse especialmente en los casos de alto grado cuando se produce una gran liberación local de heparina, histamina y otras aminas vasoactivas, relacionadas con desgranulación de los mastocitos que culminan con anormalidades coagulativas regionales.
Síndrome paraneoplásico
Otros signos que se observan en los perros con mastocitoma, sobre todo en estadios avanzados, son los síndromes paraneoplásicos (signos sistémicos que ocurren en lugares distantes de la neoplasia primaria). En el caso de mastocitoma, el síndrome paraneoplásico está asociado a la desgranulación de compuestos bioactivos como la histamina, heparina y enzimas proteolíticas. Los mastocitos neoplásicos tienen de 25 a 50 veces más histaminas que el normal, lo que puede dar como resultado hasta un 75 % de aumento en la concentración plasmática de esta sustancia en perros con mastocitoma.
La liberación sistémica de histamina causa la dilatación de arterias y arteriolas lo que aumenta la permeabilidad capilar por acción sobre los receptores de histamina H1 y H2, que a su vez provoca la disminución de la resistencia vascular y la presión arterial sistémica.
Diagnóstico
Como para cualquier diagnóstico en medicina veterinaria, se debe comenzar con la elaboración de la historia clínica del paciente, con una anamnesis adecuada, seguida del mapeo y medición de las lesiones y la evaluación de los ganglios linfáticos regionales.
Citología
El diagnóstico se basa en el análisis microscópico del tejido afectado. La citología se recomienda como examen inicial, por ser un examen simple, poco invasivo y que diagnostica en promedio el 92-96 % de los casos de mastocitoma canino. La punción aspirativa con aguja fina (PAAF) es el método de muestreo más indicado para el estudio citológico de las lesiones nodulares.
Histopatología
Las biopsias incisionales están indicadas en casos de mastocitomas cuyos márgenes serían difíciles de obtener (por ubicación o tamaño) y hay sospecha de un alto grado por la citología, la agresividad macroscópica y metástasis. La biopsia puede proporcionar información adicional sobre el tumor y su pronóstico, así como ayudar al establecimiento de una terapia específica. Las desventajas incluyen el mayor costo y tiempo de resultado, riesgo de dehiscencia de la sutura y progresión de la neoplasia.
Estadificación
Como para todos los pacientes con cáncer, los exámenes de rutina como un recuento sanguíneo completo, bioquímica sérica (perfil renal y hepático), coagulograma y análisis de orina son necesarios para evaluar el estado general del paciente. Sin embargo, la decisión terapéutica se basará necesariamente en los términos de la estadificación clínica.
Las metástasis a distancia se investigan para encontrar los sitios metastásicos más frecuentemente afectados por el mastocitoma, especialmente el hígado y el bazo, con la ayuda de la ecografía abdominal. En caso de alteración de la ecogenicidad se debe realizar una aspiración ecoguiada para el posterior estudio citológico de la muestra (aunque hay que tener en cuenta las concentraciones variables de mastocitos que también se producen en estos órganos). La punción de la médula ósea puede recomendarse en bicitopenias y anomalías hematológicas injustificables, pero la invasión de la medular suele ser un evento tardío con un impacto clínico grave en los pacientes con mastocitoma.
Las recomendaciones anteriores sobre la realización de exámenes de imagen y mielogramas para la estadificación clínica de perros con mastocitoma son inconsistentes, ya que la metástasis en los órganos abdominales o en la médula ósea ocurre sólo secundaria a metástasis en los ganglios linfáticos o la piel y eso, la presencia natural de mastocitos en los órganos linfoides como el hígado, el bazo y la médula ósea hace que sea difícil caracterizarlos, especialmente en las primeras etapas de la diseminación tumoral. Por lo tanto, se debe elegir, dependiendo de cada caso, una estadificación simple, completa o extendida.
Tratamiento
Debido a la extensa lista de factores pronósticos establecidos para el mastocitoma canino y la amplia variación de comportamiento biológico, la toma de decisiones sobre el tratamiento es complejo y debe realizarse de forma individual para cada paciente, después de una revisión cuidadosa mediante la anamnesis, examen físico y determinación del riesgo de muerte relacionada con la enfermedad.
Cirugía
La cirugía es el tratamiento de elección para los tumores localizados en la piel, en las regiones que permiten la escisión amplia y en la ausencia de metástasis a distancia. Históricamente, se han recomendado márgenes quirúrgicos de tres a cinco centímetros en cada dirección, incluyendo en profundidad. La extirpación incompleta del mastocitoma se asocia con un mayor riesgo de recidiva local, sin embargo:
Terapias adyuvantes locales
Los pacientes de bajo riesgo tras la resección del tumor no tienen necesidad de un tratamiento adyuvante sistémico. Sin embargo, las terapias adyuvantes locales como la terapia de radiación local y la electroquimioterapia pueden estar indicadas en la zona de confirmación de los márgenes comprometidos. La combinación de cirugía y radiación ionizante parece ser muy eficaz en este contexto, de forma que hasta el 94 a 97 % de los casos pueden llegar a los doce meses libres de enfermedad. Se puede optar por protocolos hipofraccionados, en dosis de 800 cGy, utilizándose 6-9 MeV, en cuatro fracciones semanales.
Como alternativa, se puede utilizar la electroquimioterapia en el lecho quirúrgico o después de la cirugía, con solo una sesión. La electroquimioterapia es una técnica que ha ampliado las perspectivas de tratamiento oncológico, especialmente en los países en desarrollo, cuando son casos inoperables o no es posible la resección completa con márgenes libres. Un estudio evaluó las biopsias de mastocitoma antes y después de la electroquimioterapia con cisplatino y la electrotransferencia del gen de la IL-2, por histopatología e inmunohistoquímica. En los tumores con una respuesta clínica completa, la tasa de proliferación celular fue pronunciadamente menor, con una respuesta inmunitaria y antiangiogénica aumentadas significativamente.
Tratamiento adyuvante sistémico
Los pacientes con un riesgo intermedio pueden beneficiarse de tratamientos adyuvantes, especialmente en los casos de mastocitomas de grado II Patnaik y bajo grado de Kiupel, o grado III Patnaik, con elevada proliferación celular y presencia de mutaciones en el exón 11 del gen c-KIT. En presencia de la mutación se recomienda el uso de inhibidores de la tirosina-cinasa aisladamente o en asociación con la quimioterapia convencional (vinblastina o lomustina).
En otros casos, la quimioterapia parece representar la mejor opción adyuvante, con el objetivo de reducir el riesgo de recurrencia tumoral, metástasis y muerte relacionadas con la enfermedad, o incluso para aumentar el tiempo libre de la enfermedad y de supervivencia global. Muchos protocolos pueden utilizarse solo o en combinación.
A pesar de la falta de estudios controlados, la asociación de vinblastina (2-2,60 mg/m² en 6 sesiones semanales, seguidas de 4 sesiones con intervalo de 14 días, preferido por el autor) y prednisolona (40 mg/m², cada 24 horas durante 7 días, 25 mg/m², cada 24 horas para más de 30 días y 25 mg/m², cada 48 horas para más de 60 días), parece haberse convertido en el protocolo de elección para la mayoría de los perros con mastocitoma. Se puede realizar el aumento escalonado de la dosis de vinblastina, basada en exámenes de sangre realizados antes de la quimioterapia, dirigida a aumentar la eficacia. Un estudio demostró que los pacientes con mastocitoma grado III presentaron una tasa de supervivencia de 1374 días con este protocolo. También se observó que los pacientes con tumores de grado II tuvieron supervivencia más de 3 años.
Inhibidores de la tirosina-cinasa
La determinación de la posibilidad de la resección quirúrgica del mastocitoma puede requerir experiencia y sabiduría del oncólogo veterinario. Los mastocitomas inoperables deben abordarse desde un punto de vista completamente distinto a lo expuesto anteriormente. La realización de una biopsia incisional es muy recomendable para la verificación de los factores pronósticos y predictivos de la terapia que será instaurada. A pesar de esperarse mejor respuesta a los inhibidores de tirosina-cinasa en aquellos pacientes que presentan duplicaciones internas en tándem del exón 11 del gen c-KIT, este tratamiento se recomienda como primera opción en todos los casos inoperables, en los que se ha de optar por fármacos autorizados para su uso en medicina veterinaria: mesilato de masitinib y fosfato de toceranib. Todavía no existen factores bien establecidos para predecir la respuesta al tratamiento y la respuesta inicial a estos fármacos es el mejor factor pronóstico para estos pacientes. La historia de recurrencia tumoral y tratamientos antineoplásicos previos pueden comprometer la eficacia de los inhibidores de la tirosina-cinasa, mientras que el uso concomitante de glucocorticoides puede afectar la respuesta e inducir su resistencia, principalmente la del masitinib, por un aumento de la expresión de la glicoproteína P. El mesilato de masitinib es un inhibidor de molécula pequeña de la tirosina-cinasa capaz de regular la actividad de los mastocitos debido a la inhibición del receptor KIT (KITr) (así como otros fármacos de esta clase) y a la concomitante inhibición de otras proteínas-quinasas, entre las que destacan:
Prevención
Los pacientes con dermatopatías crónicas tienen una mayor predisposición a desarrollar mastocitomas por un estímulo inflamatorio exacerbado que induce la formación de tumores. Por lo tanto, se cree que el control de enfermedades de la piel puede, al menos parcialmente, ayudar en la prevención de tumores de la piel, como el mastocitoma. Se necesitan más estudios sobre la influencia hormonal y la castración en el desarrollo del mastocitoma con el fin de determinar la utilidad real y seguridad de este procedimiento en estos pacientes.





