Trabajo Científico
Un paseo por la conservación a través de espermatozoides de gatos domésticos
Efecto de la adición de disacáridos, detergentes y amidas a un diluyente tris base sobre la supervivencia espermática al descongelado en felinos domésticos y la importancia para los felinos silvestres.
Dra. MV Bonaura M. Candela*

Introducción
Los espermatozoides de la cola epididimal pueden ser recuperados, congelados y almacenados para su posterior uso.
La criopreservación es una biotecnología reproductiva de gran importancia para ser utilizada en animales en vías de extinción.
La incorporación de diferentes modificaciones en los protocolos de congelación de espermatozoides felinos tiene por fin introducir mejoras que aumenten la supervivencia espermática al descongelado.
La incorporación de disacáridos, detergentes y amidas a un diluyente Tris base provocaría un efecto benéfico en la viabilidad espermática al descongelado.
En la actualidad son muchas las especies de felinos salvajes que se encuentran amenazadas o en vías de extinción.
Los esfuerzos realizados para preservar estos félidos silvestres en vías de extinción se sumarían al esfuerzo mundial para evitar las pérdidas de especies en el planeta.

Desarrollo
El felino doméstico (Felis catus) y los caninos (Canis familiaris) son animales de compañía en los cuales la aplicación de biotecnologías reproductivas no ha alcanzado el grado de desarrollo ocurrido en los animales de producción.
En la actualidad son muchas las especies de felinos salvajes que se encuentran amenazadas o en vías de extinción. Esto se debe por un lado a la caza indiscriminada, y por otro a la pérdida de su hábitat (Díaz y Ojeda, 2000; Díaz y Ojeda, 2012; Jiménez Vaquero, 2013).
Los felinos domésticos son utilizados como modelo experimental de felinos silvestres debido a su relación filogenética. El conocimiento sobre la fisiología reproductiva felina ha mejorado el desarrollo de técnicas que son aplicables a felinos no domésticos (Luvoni, 2006; Silva y col., 2000; Rodrigues da Paz, 2012; Vargas y col., 2007; Ptaszynska, 2007; Axner, 2008). Es así que los conocimientos sobre criopreservación de espermatozoides de felinos domésticos pueden ser de suma utilidad en félidos silvestres en vías de extinción ya que permiten, aumentar sus posibilidades de preservación (Pukazhenthi y col., 2006; Díaz y Ojeda, 2000; Díaz y Ojeda, 2012).
Las biotecnologías reproductivas usadas en animales domésticos, han sido implementadas en animales silvestres con el fin de ser utilizadas en zoológicos, reservas o parques y preservar así especies amenazadas (Comizzoli y col., 2000; Dresser y col., 1986).
La expansión de biotecnologías reproductivas con el fin de promover la diversidad genética en poblaciones reducidas se ha convertido en una necesidad.
La recuperación de espermatozoides epididimales (EE) y criopreservación espermática son herramientas de gran potencial para rescatar material genético. Es así que la recuperación espermática epididimal ofrece un material sumamente valioso a la hora de conservar material genético de un individuo que ha sufrido muerte súbita o debe someterse a orquiectomía. Probablemente la principal ventaja de la recuperación espermática epididimal es que permite recolectar espermatozoides (E) maduros y fértiles que podrán ser criopreservados y almacenados para su posterior uso extendiendo, así la vida reproductiva de un individuo. Este hecho toma especial importancia en animales en vías de extinción. En la Argentina dentro de los félidos silvestres amenazados se encuentran el Yaguareté (Panthera onca), Gato andino (Oreailurus jacobita), Ocelote o gato onza (Leopardus pardalis) y Gato del pajonal (Leopardus calacalo; Díaz y Ojeda, 2000; Díaz y Ojeda, 2012).
Los esfuerzos realizados para preservar estos félidos silvestres en vías de extinción se sumarían al esfuerzo mundial para evitar las pérdidas de especies en el planeta.
Los espermatozoides felinos pueden ser recolectados mediante electroeyaculación, utilizando una vagina artificial (VA), por medio de sondaje uretral y recuperado epididimal (Sojka y col., 1970; Zambelli y Cunto, 2006; Stornelli MC y Stornelli MA, 2002; Stornelli, MA, 2007a b; Hay y Goodrowe, 1993; Axner y Linde-Forsberg, 1998; Tittarelli y col., 2006; Platz y col., 1978; Seager, 1976; Pineda y Dooley, 1984; Zambelli y col., 2010a; Fiellers y col., 2010).
Si bien el método de elección es la electroeyaculación hay situaciones en las que el único método posible es el recuperado epididimal, por ejemplo ante la muerte repentina de un animal (ANI).
Los espermatozoides deben ser recuperados de la cola epididimal y procesados lo más rápido posible luego de la obtención del epidídimo. Este hecho permite obtener una gran cantidad de espermatozoides viables (Hay y Goodrowe, 1993; Axner y Linde-Forsberg, 1998; Tittarelli y col., 2006). Sin embargo si la obtención inmediata de espermatozoides de la cola epididimal no es posible, el almacenado del órgano bajo ciertas condiciones permite obtener espermatozoides viables (Luvoni, 2006; Tittarelli y col., 2006; Tittarelli y col., 2012; Yu y Leibo, 2002; Harris y col., 2001).
Luego de su recolección, los EF pueden ser preservados mediante la adición de un diluyente adecuado y su inmersión en nitrógeno líquido (criopreservación).
El diluyente debe permitir obtener altos porcentajes de espermatozoides vivos con motilidad progresiva e integridad acrosómica luego del proceso de congelación-descongelación, de esta manera conseguir altas tasas de fertilidad in vivo.
Para cumplir con estos objetivos el diluyente necesita contener azúcares como fuente de energía, sustancias buffer que controlen los cambios de pH, antibióticos que eviten el crecimiento bacteriano y crioprotectores que reduzcan la posibilidad de daño de los espermatozoides durante los procesos de congelación y descongelación (Concannon y Battista, 1989).
Mediante la criopreservación, es posible detener el proceso que sufre el espermatozoide desde la eyaculación hasta la fecundación y conservarlo en el tiempo potencialmente fértil (Watson, 1995).
En algunas especies la conservación de semen es exitosa, sin embargo en otras esta aplicación es problemática. La pobre supervivencia espermática representa uno de los mayores aspectos del problema (Holt, 2000).
La criopreservación requiere el refrigerado, equilibrado y empaquetado de la muestra. El enfriado, congelado y descongelado son eventos que producen estrés sobre la célula espermática, por lo tanto los espermatozoides criopreservados poseen menor capacidad fecundante en comparación con los espermatozoides frescos (Watson, 1995).
En 1993 White postuló que en el eyaculado los espermatozoides interactúan con componentes del fluido seminal, que modifican la funcionalidad espermática lo cual puede cambiar las propiedades de la membrana espermática y la respuesta a diferentes tratamientos (White, 1993).
El plasma seminal contiene factores que son benéficos en algunas funciones espermáticas como motilidad, capacitación, reacción acrosómica, viabilidad y/o interacción espermatozoide-ovocito. Sin embargo estos factores pueden ser dañinos especialmente en la preservación de los espermatozoides, incluyendo la criopreservación (Manjunath y Therien, 2002; Bergeron y Manjunath, 2006). Es así que su presencia ha sido asociada con alta sensibilidad al shock de frío en porcinos (Pursel y col., 1972). En contraposición, se observó que su remoción no afectó la viabilidad al descongelado en ovinos (Salamon y col., 1973). Se puede decir que el plasma seminal contiene factores que son benéficos y/o perjudiciales a la función y/o al almacenado. La naturaleza y característica de esos factores no se conoce en su totalidad (Manjunath y Therien, 2002).
Recientemente se ha comunicado que en el felino doméstico altas concentraciones de colesterol y triglicéridos en el plasma seminal están relacionadas con una mejor calidad seminal (García y col., 2013).
Al compararse espermatozoides de eyaculado con espermatozoides de la cola del epidídimo se ha observado que no existen diferencias en la calidad de los espermatozoides frescos o luego de la congelación (Tebet y col., 2006; Luvoni, 2006).
Algunos trabajos han mostrado que según el método de recolección pueden variar el volumen y concentración de espermatozoides obtenidos, así como también algunas anormalidades espermáticas, observándose mayor cuantía de morfoanomalías en los espermatozoides de origen epididimal (Axner y col., 1998; Villaverde y col., 2006; Pukazenthi y col., 2002).
La criopreservación de espermatozoides tanto seminales como epididimales y su posterior utilización, mediante implementación de distintas biotecnologías como lo son la inseminación artificial (IA) o inyección intracitoplasmática de espermatozoides (ICSI), permitiría gracias al uso de material genético de gran valor, conservar la biodiversidad de las poblaciones y evitar la extinción de algunas especies amenazadas.
La IA con espermatozoides criopreservados puede ser útil cuando la hembra y el macho se encuentran en lugares distantes o cuando el macho ya no está disponible para el servicio natural.
Luego de la primer comunicación realizada por Platz en 1978, de nacimientos logrados mediante IA con semen felino congelado, se han realizado variados estudios sobre congelación de semen e IA utilizando semen criopreservado (Platz y col., 1978; Axner y col., 2004; Hermansson y Axner, 2007; Siemieniuch y Dubiel, 2007; Zambelli y col., 2002). El interés por el conocimiento de las diferentes biotecnologías reproductivas en felinos ha ido aumentando y ha impulsado el desarrollo e implementación de las mismas.
Varios protocolos de congelación de semen han sido desarrollados en la última década con el objetivo de minimizar los daños celulares asociados a la criopreservación, sin embargo, los estudios sistemáticos son pocos ya que el bajo número de espermatozoides obtenidos en cada eyaculado así como la dificultad para trabajar con gran número de animales limita la posibilidad de realizar varios tratamientos en un mismo experimento (Chatdarong y col., 2010).
Si bien existen algunas comunicaciones sobre la recuperación y criopreservación de EE en felinos (Hay y Goodrowe, 1993; Pushett y col., 2000; Axner y col., 2004; Luvoni, 2006; Tebet y col., 2006).
Hay pocos estudios de la influencia de diferentes crioprotectores incorporados al diluyente de congelación sobre la supervivencia espermática tanto seminal como epididimal al descongelado. Basándose en estudios realizados en caninos, Chatdarong ha desarrollado un protocolo para la preservación de EF (Chatdarong y col., 2007).
Se sabe que los procesos de criopreservación provocan alteraciones de las membranas y del metabolismo celular así como pérdida de la motilidad espermática, provocando disminución de la fertilidad al descongelado (Hammerstedt y col., 1990; Watson, 1995).
La función de las membranas espermáticas está determinada por la interacción de los diversos componentes, y cualquier evento ocurrido durante el proceso de criopreservación capaz de alterar esta interacción puede esperarse que altere su función (Aloia, 1988).
Durante el proceso de congelación se pierde aproximadamente el 50% de la población inicial de espermatozoides debido a los efectos del proceso sobre las membranas, citoesqueleto, aparato motor y núcleo del espermatozoide (Watson, 1995; Mazur y col., 1970; Parks y Lynch, 1992). Los cambios más evidentes son la pérdida de la motilidad espermática y la pérdida de la integridad acrosómica (Paulens, 1993).
Obtener un alto porcentaje de espermatozoides fértiles luego del proceso de congelación-descongelación traerá como resultado un mayor porcentaje de preñez y camadas más numerosas. Este hecho se encuentra íntimamente relacionado con la conservación de la integridad estructural y fisiológica del espermatozoide al descongelado (Held, 1997). Para poder interactuar con el ovocito, el espermatozoide debe estar vivo, mótil y poseer la membrana plasmática y acrosomal intactas y funcionales (Stornelli MC y col., 2005).
Uno de los factores más importantes que modifican la integridad de las membranas (IM) de los espermatozoides son los relacionados con las características físico-químicas de los diluyentes utilizados, los cuales pueden provocar alteraciones ultraestructurales, bioquímicas y funcionales en la célula espermática (Stornelli MC y col., 2005). Por lo tanto, entre los factores que pueden producir daño sobre los espermatozoides durante los procesos de criopreservación, se encuentran además del estrés térmico, aquellos relacionados con los efectos tóxicos provocados por los diferentes crioprotectores y la formación de hielo en el medio extra e intra celular (Gao y col., 1993; Gao y col., 1995; Watson, 1976; Watson, 1981; Watson y Duncan, 1988).
En la última década se han estudiado diferentes diluyentes para la criopreservación de semen felino. Los más utilizados son los que contienen Tris Base (TRIS), con el agregado de distintas sustancias como por ejemplo: crioprotectores (glicerol [GLY], disacáridos), macromoléculas protectoras de membranas (lipoproteínas de yema de huevo, proteínas de la leche, glicoproteínas), detergentes del grupo alquil-iónico que actúan sobre la yema de huevo (dodecil sulfato de sodio [SDS]) y azúcares energéticos permeables (glucosa), capaces de atravesar la membrana plasmática (Axner y col., 2004; Siemieniuch y Dubiel, 2007.
La formulación de un diluyente Tris base que posea en su composición el agregado de más de un crioprotector potenciando sus acciones protectoras mejoraría la viabilidad y los parámetros espermáticos evaluados al descongelado.
Los procesos de congelación-descongelación producen alteraciones importantes en la membrana plasmática y acrosómica así como en la distribución del contenido acrosomal.
Realizamos un trabajo con la conservación de más de 100 muestras de material seminal, de numerosos animales, de diversos orígenes, de animales maduros sexualmente y sanos.
El trabajo se dividió en nueve experimentos. Se diseñaron 8 experimentos con el fin de evaluar el efecto sobre la supervivencia espermática al descongelado de la adición de una amida, un detergente y un disacárido (DMF, SDS y TREA, respectivamente), o una combinación de estos componentes a un diluyente Tris base.
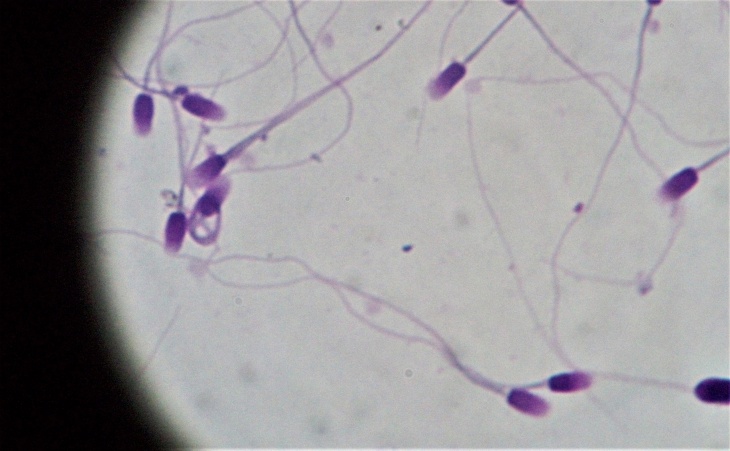
Resultados
En los resultados pudimos observar que con el agregado de disacáridos o amidas al diluyente Tris base no se mejoró la congelabilidad de los espermatozoides felinos. Sin embargo, se observó un efecto protector sobre los espermatozoides al agregar un detergente y al combinar un detergente y un disacárido al diluyente de congelación.
Concluyendo que en felinos domésticos, el agregado de detergente solo o en combinación con disacáridos al diluyente Tris base mejora la viabilidad espermática al descongelado. Sin embargo, sólo una prueba de fertilidad a campo permitiría evaluar la capacidad fecundante de esos.
Futuras Publicaciones: Una parte muy importante de este trabajo fue realizar la evaluación de las alteraciones ultramicroscópicas observadas en los espermatozoides felinos frescos/congelados-descongelados.
*Dra. MV Bonaura M. Candela
CV Resumido
Médica Veterinaria - FCV-UNLP.
Doctora en Ciencias Veterinarias - FCV-UNLP.
Ex investigadora CONICET.
Docente FCV-UNLP.
Investigadora y manejo de Centro de Manejo y Asesoramiento Reproductivo.
Analista de Investigación y Comunicación Científica en Vitalcan SA.
Dirección y dictado de cursos de posgrado para estudiantes y graduados en la carrera de Ciencias Veterinarias, en las áreas de Nutrición, Reproducción y Neonatología (plataforma online IntelVet).
Agradecimientos
A mi directora de tesis, mis compañeras/os de laboratorio y colegas de Argentina y Brasil; por acompañarme durante mis investigaciones. Al centro de zoonosis de La Plata.
A la empresa Vitalcan SA. por colaborar con la nutrición de los animales incluidos en el estudio.
Bibliografía
1. Aloia, R.C., Curtin, C.C., Gordon, L.M. Lipid Domains and the relationship to membrane function. In: Alan R. Liss, Inc, New York; 1988:301.
2. Axner E, Hermansson U, Linde-Forsberg C. The effect of Equex STM paste and sperm morphology on post-thaw survival of cat epididymal spermatozoa. Anim Reprod Sci 2004; 84(1-2):179-91.
3. Axner E, Linde-Forsberg C. Mating and artificial insemination in domestic cats. En: Manual of Small Animal Reproduction and Neonatology (eds) Simpson G., England GCW and Harvey MJ. Cheltenham: BSAVA, 1998; p. 105-11.
4. Bergeron A, Manjunath P. New insights toward understanding the mechanism of sperm protection by egg yolk and milk. Mol Reprod Dev 2006; 73(10):1338-44.
5. Chatdarong K, Axner E, Manee-In S, Thuwanut P, Linde-Forsberg C. Pregnancy in the domestic cat after vaginal or transcervical insemination with fresh and frozen semen. Theriogenology 2007; 68(9):1326–33.
6. Chatdarong K, Thuwanut P, Manee-in S, Lohachit C, Axnér E. Effects of thawing temperature and post-thaw dilution on the quality of cat spermatozoa. Reprod Domest Anim 2010; 45(2):221-7.
7. Comizzoli P, Mermillod P, Mauget R. Reproductive biotechnologies for endangered mammalian species. Reprod Nutr Dev 2000; 40(5):493-504.
8. Díaz GB, Ojeda RA. Libro Rojo de Mamíferos Amenazados de la Argentina. Mendoza, SAREM. (Sociedad Argentina para el Estudio de los Mamíferos), 2000, p 106.
9. Díaz GB, Ojeda RA. Libro Rojo de Mamíferos Amenazados de la Argentina. Mendoza, SAREM. (Sociedad Argentina para el Estudio de los Mamíferos), 2012, p 193.
10. Dresser BL, Sehlhorst CS, Keller G, Kramer LW, Reece RW. Artificial insemination and embryo transfer in the felidae. Proceedings of International Symposium for World Conservation Strategies for Tigers, Cincinnati, Ohio, USA, 1986, p. 4-18.
11. Filliers M, Rijsselaere T, Bossaert P, Zambelli D, Anastasi P, Hoogewijs M, Van Soom A. In vitro evaluation of fresh sperm quality in tomcats: a comparison of two collection techniques. Theriogenology 2010; 74(1):31-9.
12. Gao DY, Ashworth E, Watson PF, Kleinhans FW, Mazur P, Critser JK. Hyperosmotic tolerance of human spermatozoa: separate effects of glycerol, sodium chloride and sucrose on spermolysis. Biol Reprod 1993; 49(1):112-23.
13. García F, Nuñez Favre R, Stornelli MC, García Mitacek MC, Praderio RG, Stornelli MA. Relación entre parámetros seminales y concentración de colesterol y triglicéridos en plasma seminal felino. Cs Morfol; 2013; 15(2):62.
14. Harris RF, Pope CE, Gomez MC, Leibo SP, Dresser BL. Storage of domestic cat spermatozoa for extended periods at 4°C. Theriogenology 2001; 55(1):308.
15. Hermansson U, Axnér E. Epididymal and ejaculated cat spermatozoa are resistant to cold shock but egg yolk promotes sperm longevity during cold storage at 4 degrees C. Theriogenology 2007; 67(7):1239-48.
16. Holt WV. Fundamental aspects of sperm cryobiology: the importance of species and individual diferences. Theriogenology 2000; 53(1):47-58.
17. Lengwinat T, Blottner S. In vitro fertilization of follicular oocytes of domestic cat using fresh and cryopreserved epididymal spermatozoa. Anim Reprod Sci 1994; 35(3-4):291-301.
18. Luvoni CG. Gamete cryopreservation in the domestic cat. Theriogenology 2006; 66(1):101-11.
19. Manjunath P, Therien I. Role of seminal plasma phospholipid-binding proteins in sperm membrane lipid modification that occurs during capacitation. J Reprod Immunol 2002; 53(1-2):109-19.
20. Mazur P, Leibo SP, Farrant J, Chu EHY, Hanna MG, Smith LH. Interactions of cooling rate, warming rate and protective additive on the survival of frozen mammalian cells. En: Ciba Fundation Symposium. The Frozen Cell. John Eiley y sons, Ltd. Wolstenholme, G.E.W., O´Connor, M. (Eds.), The Frozen Cell, Churchill, London, 1970, p 69-88.
21. Parks JE, Graham JK. Effects of cryopreservation procedures on sperm membranes. Theriogenology 1992; 38(2):209-22.
22. Parks JE, Lynch DV. Lipid composition and thermotropic phase behavior of boar, bull, stallion and rooster sperm membranes. Cryobiology 1992; 29(2):255-66.
23. Pineda MH, Dooley MP. Effect of voltage and order of voltage application on seminal characteristics of electroejaculates of the domestic cat. Am J Vet Res 1984; 45(8):1520-5.
24. Platz CC, Wildt DE, Seager SW. Pregnancy in the domestic cat after artificial insemination with previously frozen spermatozoa. J Reprod Fertil 1978;52(2):279–82.
25. Pukazhenthi B, Laroe D, Crosier A, Busch ML, Spindler R, Pelican KM, Busch M, Howard JG, Wildt DE. Challenges in cryopreservation of clouded leopard (Neofelis nebulosa) spermatozoa. Theriogenology 2006; 66(6-7):1790-6.
26. Pursel VB, Johnson LA, Schulman LL. Interaction of extender composition and incubation period on cold shock susceptibility of boar spermatozoa. J Anim Sci 1972; 35(3):580-4.
27. Pushett DA, Lacham-Kaplan O, Gunn IM, Trounson AO. Intracytoplasmic sperm injection (ICSI) using epididymal sperm and in vitro-matured oocytes in domestic cat: A model for endangered species. Theriogenology 2000; 53:400.
28. Rodrigues da Paz, Regina Cecilia. Wildlife Cats reproductive biotechnology. En: Current frontiers in Cryobiology, 2012, p. 369-88.
29. Salamon S, Wilmut I, Polge C. Deep freezing of boar semen. I. Effects of diluent composition, protective agents, and method of thawing on survival of spermatozoa. Aust J Biol Sci 1973; 26(1):219-30.
30. Seager SWJ. Electroejaculation of cats (domestic and captive wild felids). En Applied electronics for veterinary medicine and animal physiology. WR Klemm, CC Thomas (Ed.). Sprinfield, 1976, p. 410-8.
31. Silva JNC, Leitao RM, Lapao NE, cunha MB, Cunha TP, Silva JP, Paisana FC. Birth of siberian tiger (Panthera Tigris altaica) cubs after transvaginal artificial insemination. J Zoo wil Med 2000; 31(4):566-9.
32. Sojka NJ, Jemings LL, Hamner CE. Artificial insemination in the cat (Felis catus L.). Lab Anim Care 1970; 20(2):198–204.
33. Squires EL, Keith SL, Graham JK. Evaluation of alternative cryoprotectants for preserving stallion spermatozoa. Theriogenology 2004; 62(6):1056-65.
34. Stornelli MA. Basic and advanced evaluation of cat’s semen. Brazilian journal of animal reproduction, 2007b; 31(1):135-40.
35. Stornelli MA. Particularices fisiológicas de la reproducción en felinos. Physiological aspects of feline reproduction. Rev Bras Reprod Anim 2007a; 31(1):71-6.
36. Stornelli MC, Stornelli MA. Evaluación, criopreservación de semen e inseminación artificial en el felino doméstico. In: Anuario Asociación Argentina de Medicina Felina. Buenos Aires: AAMeFe, 2002a; p. 87-90.
37. Tebet JM, Martins MIM, Chirinea VH, Souza FF, Campagnol D, Lopes MD. Cryopreservation effects on domestic cat epididimal versus electroejacuñated spermatozoa. Theriogelogy 2006; 66(6-7):1629-32.
38. Tittarelli CM, Jurado SB, Núñez Favre R, Bonaura MC, de la Sota RL RL, Stornelli MA. Effect of storage media and storage time on histological and ultrastructural changes in cat epididymal cells. Reprod Domest Anim 2012; 47(6):281-3.
39. Tittarelli CM, Savignone CA, Arnaudín E, Stornelli MC, Stornelli, MA, de la Sota RL. Effect of transport media and storage time on survival of spermatozoa recovered from canine and feline epididymides. Theriogenology 2006; 66(6-7):1637-40.
40. Vargas A, Sánchez I, Godoy J, Roldán E, Martínez F, Simón MA. Plan de Acción para la cría en cautividad del lince ibérico: Cuarta edición. (Iberian Lynx Captive Breeding Action Plan: Fourth Edition). Ministerio de Medio Ambiente, Madrid, 2007.
41. Villaverde Silva Balbin AI, Mello Martins MI, Bastro Castro V, Lopes MD. Morphological and functional characteristics of chilled semen obtained from domestic feline Epididymides (Felis catus). Theriogenology 2006; 66(6-7):1641-4.
42. Watson PF, Duncan AE. Effect of salt concentration and unfrozen water on the viability of slowly frozen ram spermatozoa. Cryobiology 1988; 25(2):131-42.
43. Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reprod Fertil Dev 1995; 7(4):871-91.
44. Watson PF. The effects of cold shock on sperm cell membrane. En: Morris GJ, Clark A, editores. Effects of low temperatures on biological membranes. Academic Press, London 1981; p.189-218.
45. Watson PF. The protection of ram and bull spermatozoa by the low density lipoprotein fraction of egg yolk during storage at 5º C and deep-freezing. J. Thermal Biol 1976; 1(3):137-41.
46. White IG. Lipids and calcium uptake of sperm in relation to cold shock and preservation: review. Reprod Fertil Dev 1993; 5(6):639-58.
47. Yu I, Leibo SP. Recovery of motile, membrane intact spermatozoa from canine epididymides stored for 8 days at 4 degrees C. Theriogelogy 2002; 57(3):1179-90.
48. Zambelli D, Cunto M. Semen collection in cats: Techniques and análisis. Theriogenology 2006; 66(2):159-65.
49. Zambelli D, Iacono E, Raccagni R, Merlo B. Quality and fertilizing ability of electroejaculated cat spermatozoa frozen with or without Equex STM Paste. Theriogenology 2010b; 73(7):886-92.
50. Zambelli D, Raccagni R, Cunto M, Andreani G, Isani G. Sperm evaluation and biochemical characterization of cat seminal plasma collected by electroejaculation and urethral catheterization. Theriogenology 2010a; 74(8):1396-402.